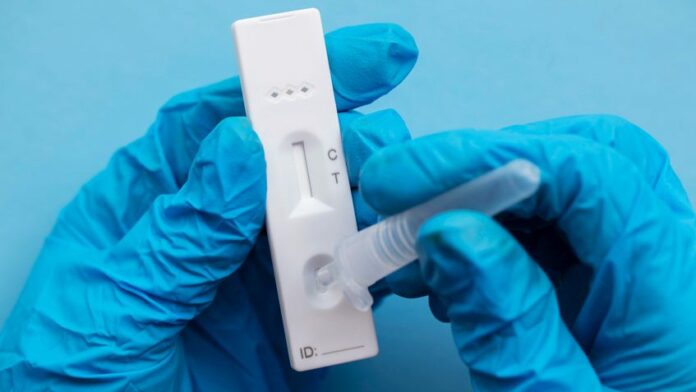
(北京12日综合电)中国国家药监局周六发布通告,批准南京诺唯赞、北京金沃夫、深圳华大因源、广州万孚生物、北京华科泰生物的冠病抗原产品自测应用申请变更。自此5款冠病抗原自测产品正式上市。
根据中国国家药监局政务门户网站发布的最新待领取信息显示,四款冠病抗原检测试剂盒产品获得的医疗器械批准证明文件(变更)待领取,批准时间均在12日,涉及4家公司。
这4家公司包括南京诺唯赞生物科技股份有限公司全资子公司南京诺唯赞医疗科技有限公司、广州万孚生物技术股份有限公司、华大基因子公司深圳华大因源医药科技有限公司、北京金沃夫生物工程科技有限公司。
加上周5获准变更的北京华科泰,获准变更的厂商已经增至5家。
目前,中国共有5家企业的5款冠病抗原检测产品获批,正是上述5款变更信息的产品。此前,这些产品仅获批用于专业人员使用,而不能自测。
中国国家卫健委周5宣布,国务院应对冠病疫情联防联控机制综合组决定在核酸检测基础上,增加抗原检测作为补充,并组织制定了《新冠病毒抗原检测应用方案(试行)》。
《方案》规定了抗原检测的适用人群:一是到基层医疗卫生机构就诊,伴有呼吸道、发热等症状且出现症状5天以内的人员;二是隔离观察人员,包括居家隔离观察、密接和次密接、入境隔离观察、封控区和管控区内的人员;三是有抗原自我检测需求的社区居民。
同时,《方案》明确了三类人群进行抗原检测需满足的主要条件、检测试剂的获得渠道,制定了检测发现阳性后的处置管理流程,促进抗原检测与核酸检测相衔接。为便于各地规范开展检测,《方案》还包括两个附件,即基层医疗卫生机构冠病病毒抗原检测基本要求及流程、冠病病毒抗原自测基本要求及流程。